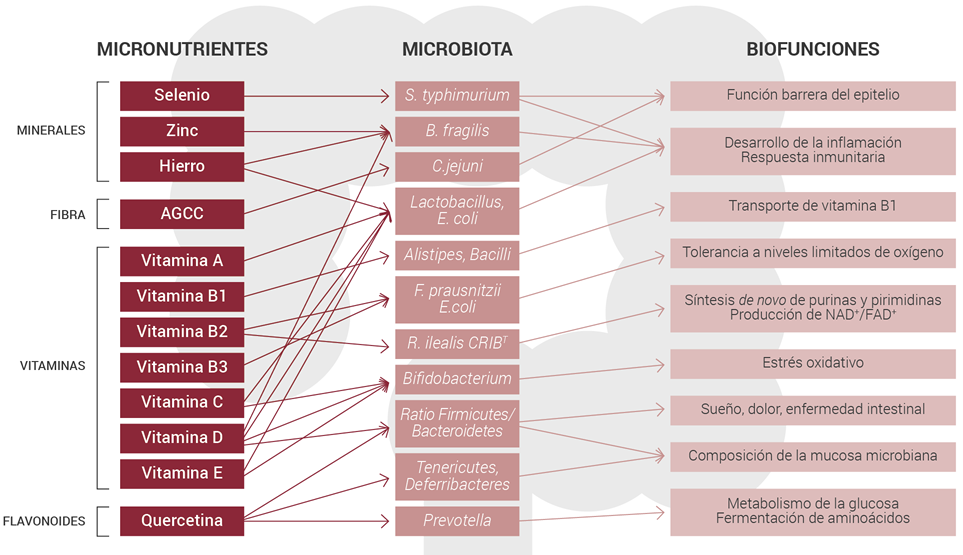
Las propiedades físicoquímicas de los alimentos, la disponibilidad de nutrientes, el tiempo de tránsito por el colon y la edad del huésped pueden modular los efectos dietéticos sobre la microbiota colónica. Los prebióticos, las vitaminas, los minerales y otras sustancias se han identificado con potencial para modificar las funciones gastrointestinales, la respuesta inmunitaria, y como resultado, la composición de las poblaciones microbianas. (Figura 1).
Vitamina B1
La habilidad de la microbiota para transportar, sintetizar, y competir por la vitamina B1 puede impactar sobre la estructura y función del microbioma debido a los cambios en la disponibilidad luminal de vitamina B1. Las bacterias intestinales que son totalmente dependientes del transporte de vitamina B1, como los miembros del género Alistipes y muchos de los miembros de Bacilli, son los que seguramente se verían más afectados por el déficit de vitamina B1.
Vitamina B2
La vitamina B2 altera el crecimiento de Faecalibacterium prausnitzii, que tiene un uso especializado de B2 como transportador de electrones extracelular, lo que le permite tolerar niveles limitados de oxígeno. La estimulación del crecimiento de F. prausnitzii mediante la exposición a vitamina B2, puede ser una función de gran interés clínico para la modulación del microbioma.
Un primer estudio piloto con la suplementación diaria de vitamina B2 mostró un incremento de F. prausnitzii y una reducción de E.coli en la mayoría de participantes.
Vitamina B3, B5 y B6
La relación entre el microbioma y la vitamina B5, B3 y B6, no está del todo clara. Sin embargo, la microbiota humana contiene enzimas que dependen de la vitamina B6, por lo que ciertas bacterias del huésped pueden aportar la necesaria para el metabolismo de las aminotransferasas bacterianas.
Vitamina B9 y B12
La producción de vitamina B9 por parte de la microbiota intestinal puede modificar los efectos de la vitamina B9 ingerida en la dieta y ya ha sido considerada como factor importante en estudios de dieta y el riesgo de cáncer de colon.
De forma frecuente se discute si la vitamina B12 bacteriana es una fuente válida para humanos. Los datos experimentales muestran que no es el caso, ya que la vitamina B12 colónica no está disponible debido a una falta de las enzimas y receptores en el colon. A pesar de la falta de absorción, la vitamina B9 y B12 regulan la expresión genética de la microbiota y controlan las interacciones genéticas entre el microbioma y el huésped. Estudios recientes han descubierto que existen determinadas cepas con patrones de rutas de síntesis que se complementan entre ellas. Este es el caso de la producción de vitamina B12 por Eubacterium halii y la producción interdependiente de propionato por Akkermansia muciniphila. Se concluye entonces que las bacterias intestinales compiten con otras especies y el huésped por la vitamina B12, indicando que la vitamina B12 luminal es importante para la microbiota intestinal.
Vitamina C y E
Un estudio exploró el efecto de la vitamina C y E sobre la microbiota, como parte de una mezcla de polifenoles, ácido lipoico y antioxidantes. El estado antioxidante mostró una correlación positiva con Lactobacillus y Bifidobacterium y una correlación negativa con E. coli. De este modo, el estrés oxidativo se relacionó de forma directa con cambios en la microbiota intestinal. Igualmente, el síndrome metabólico y una nutrición pobre en sustancias antioxidantes pueden causar el sobrecrecimiento de bacterias Gram-negativas en el intestino, incrementando la inflamación y alteración de la función intestinal y endotoxemia.
Vitamina A
Al contrario que con las vitaminas del grupo B, la microbiota intestinal no sintetiza carotenos ni retinol, pero la digestión bacteriana de las fibras, libera carotenos para ser absorbidos por los colonocitos. En modelos animales, la cantidad total de bacterias (incluyendo E. coli) en el tracto intestinal incrementó con la deficiencia de vitamina A, y la prevalencia de Lactobacillus spp. descendió en los segmentos intestinales del yeyuno, íleon y colon.
Vitamina D
Estudios realizados en bebés de 1 mes y en edades de 3 a 6 meses han detectado influencias de la vitamina D en taxones bacterianos clave. Al mes de edad, Bifidobacterium spp. y C. difficile parecen tener una correlación negativa con el consumo de vitamina D, mientras que B. fragilis presenta una relación lineal. Se observaron menores proporciones de Clostridiales en niños de 3 a 6 meses lactantes de pecho, y la vitamina D en sangre del cordón umbilical se relacionó con un incremento en Lachnobacterium y descenso de Lactococcus.
La suplementación con vitamina D ejerce un efecto positivo en pacientes con enfermedad inflamatoria intestinal (EII) o fibrosis quística, a través de la modulación del microbioma. Igualmente, tres meses de suplementación conjunta de vitaminas del grupo B y vitamina D3, frente a la suplementación única con D3, en pacientes con síndrome del intestino irritable, mejoró el sueño, el dolor y la sintomatología derivada de la consolidación de los filos Actinobacteria, Bacteroidetes, Firmicutes y Proteobacteria. Por otra parte, en individuos pylori-positivos la vitamina D3 redujo el número de células de Helicobacter spp. Finalmente, en adultos sanos, la suplementación oral de vitamina D3, confirmó el predominio de los filos Bacteroidetes y Firmicutes, mientras que las Proteobacterias descendieron en el moco del tracto gastrointestinal alto, respecto al bajo.
Mientras que algunas bacterias pueden mejorar la expresión genética del gen del receptor de la vitamina D (RVD), una desactivación condicional del RVD epitelial en el intestino conduce a disbiosis ocasionando un descenso en Lactobacillus y un incremento en Clostridium y Bacteroides.
Respecto al mecanismo de la vitamina A y D, ambas ejercen un papel en la inducción de la expresión de genes antimicrobianos (defensinas y catelcidinas) y afectan la función inmune y de barrera del intestino, lo que permite la supresión de la invasión microbiana en el epitelio.
Hierro (Fe)
Tanto los estudios realizados en animales como en humanos han reportado cambios inducidos por la suplementación con Fe entre los que se incluyen incremento en Bacteroides spp, Enterobacteriaceae, y descenso de Bifidobacteria y Lactobacillus, y una expansión oportunista de patógenos como Salmonella, E. coli y C. difficile.
Zinc (Zn)
Estudios en modelos animales han detectado que la deficiencia en Zn produjo cambios remarcables en la microbiota como cambios metabólicos, reducción de la producción de ácidos grasos de cadena corta (AGCC) y una consecuente disminución en la absorción de Zn. Concretamente, la suplementación con Zn incrementó los grupos bacterianos anaeróbicos facultativos gram-negativos, la concentración colónica de AGCC, así como la riqueza y diversidad de especies en general.
Selenio (Se)
La suplementación suficiente o supra nutricional de Se incrementa la resistencia a Salmonella typhimurium expresada como menor carga de S. typhimurium en los tejidos, mayor función barrera y menor inflamación intestinal.
El Se y las selenoproteínas impactan las vías de señalización inflamatorias implicadas en la patogénesis de la enfermedad inflamatoria intestinal (EII). Concretamente, los niveles de Se inciden en dos factores de transcripción, NF-kB y peroxisome proliferator activated receptor (PPAR-γ), ambos involucrados en la activación de las células inmunitarias y en las diversas fases de la inflamación y resolución. La relación entre estos tres factores, Se, NF-kB y PPAR-γ, pueden aportar nuevos abordajes para EII.
Fibras dietéticas
Los prebióticos cuando se consumen inducen cambios en la composición y/o la actividad de las bacterias gastrointestinales junto con un incremento de la producción de AGCC. Entre las características beneficiosas de los prebióticos se incluyen la fermentación selectiva, modulación del pH intestinal, volumen fecal, prevención de la colonización por parte de patógenos y control de las bacterias putrefactivas. Algunos prebióticos son los beta glucanos, fructooligosacáridos (FOS), oligofructosa, inulina, galactooligosacáridos (GOS), goma guar, almidón resistente y maltodextrinas, xilooligosacáridos y arabinooligosacáridos.
Los AGCC más abundantes son el acetato, propionato y butirato, y normalmente se encuentran en el ratio 3:1:1 y constituyen del 90-95% de los AGCC producidos en el colon. El acetato y el propionato pueden ser absorbidos por el lumen e involucrarse en la homeostasis metabólica, mientras que el butirato representa el 70% de la energía para los colonocitos y está implicado en funciones como la regulación inmunitaria, el crecimiento celular y la función de barrera del intestino nutriendo las proteínas integrantes de las uniones estrechas. Además, el butirato se ha estudiado como un regulador de la inflamación, ya que modula la producción de citoquinas, la actividad de las quinasas y las vías de señalización inmunes asociadas, entre las que destacan la regulación al alza de la interleuquina 10 (IL-10), los receptores acoplados a proteína G (GPRs), e inhibición de múltiples mediadores inmunitarios celulares como los receptores Toll like ligados a Il-12, NF-kβ y las deacetilasas de histonas.
La suplementación con fibras insolubles, incrementa la producción de butirato y ésta implica tanto su síntesis como la degradación de los polisacáridos. Eubacterium rectale y Faecalibacterium praunitzi son dos especies involucradas en la producción de butirato intestinal, mientras que otras especies se encargan de la degradación del almidón resistente como Ruminococcus y Bifidobacterium.
Es interesante el efecto bidireccional del butirato. Por una parte, cuando se produce un proceso de diarrea o disbiosis inducida por antibiótico, las bacterias productoras de butirato descienden de forma significativa, así como el butirato alterando la renovación de los enterocitos.
Flavonoides
La mayoría de estudios para determinar el impacto de los flavonoides sobre el microbioma intestinal se han basado en relacionar la composición microbiana con estados patológicos determinados, y los hallazgos se han centrado en el ratio Firmicutes/Bacteroidetes, y el estadío metabólico de la enfermedad. La quercetina, ha mostrado estabilizar este ratio e inhibir el crecimiento de especies bacterianas asociadas con la obesidad.
Carotenoides
De forma general, niveles elevados de carotenoides en suero se relacionan con una reducción del riesgo de enfermedades crónicas, y contribuyen a la salud del microbioma intestinal.
Un estudio control aleatorizado a largo plazo realizado en humanos, inicialmente identificó una asociación de las concentraciones séricas de carotenoides y las bacterias de la mucosa del colon, pero a largo plazo, no se encontró ningún efecto.
Los datos anteriormente expuestos, aportan evidencia prometedora sobre cómo los micronutrientes pueden modificar el microbioma. Quedan claros los efectos beneficiosos de los AGCC sobre el microbioma y sugieren una relación simbiótica dieta-dependiente entre el microbioma y su huésped. Además, es evidente que los micronutrientes juegan un papel importante en esta relación multidireccional y deberían ser contemplados como elementos de prevención y tratamiento para combatir las patologías derivadas del microbioma.
Kaleigh E. Beane, Mersady C. Redding, Xiaofan Wang, Jeong Hoon Pan, Brandy Le, Cara Cicalo, Suwon Jeon, Young Jun Kim, Jin Hyup Lee, Eui-Cheol Shin, Ying Li, Jiangchao Zhao and Jae Kyeom Kim. Effects of dietary fibers, micronutrients, and phytonutrientes on gut microbiome: a review. Appl Biol Chem. 2021; 64:36.

CN Base aporta equipos micronutricionales de vitaminas, minerales y dosis efectivas de factores vitamínicos como coenzima Q10 y ácido R-lipoico. Estos conjuntos micronutricionales se presentan en las formas moleculares clave para poder ser absorbidas en caso de ser portadores de polimorfismos genéticos poco favorables. Se aportan las vitaminas en forma activa (metilfolato, metilcobalamina, dibencozida, riboflavina 5’fosfato y piridoxal 5’fosfato), que junto con los otros coenzimas vitamínicos y cofactores metálicos, pueden ayudar a modular de forma equilibrada el microbioma y ser herramientas de gran utilidad para el abordaje de patologías derivadas de un desequilibrio microbiómico.
Petit CN Base es un conjunto equilibrado de los 24 micronutrientes más importantes para un óptimo desarrollo, junto a scFOS y S. boulardii. Es un complemento micronutricional para el embarazo, lactancia y niños en crecimiento, compuesto por vitaminas, minerales, colina, fructooligosacáridos de cadena corta con acción prebiótica y Saccharomyces boulardii con acción probiótica. Entre las vitaminas destacan las formas activas más biodisponibles de ácido fólico (metilfolato), vitamina B12 (metilcobalamina); vitamina B6 (piridoxal 5-fosfato); vitamina B2 (riboflavina 5-fosfato); vitamina D (colecalciferol), vitamina A (retinol)… Entre los minerales, encontramos el hierro liposomado, el zinc en forma de gluconato junto con otros minerales en forma de citratos. La mezcla simbiótica de scFOS y S. boulardii modula la microbiota intestinal evitando la unión de patógenos a la mucosa intestinal, regulando la inflamación y restableciendo los niveles de AGCC.
CN Base y Petit CN Base forman parte del programa de La Micronutrición Básica.
La Micronutrición Básica se compone de CN Base o Petit CN Base, Omega Base y Amino Base, que aporta los conjuntos micronutricionales necesarios para un óptimo funcionamiento del organismo. En su composición se escogen los micronutrientes más biodisponibles, bioidénticos y/o bioaccesibles por el organismo, para facilitar la mayor impregnación de los micronutrientes en tejidos y células. No interaccionan con los fármacos y pueden ser administrados a cualquier persona independientemente de la edad, sexo o condición de salud y con cualquier tipo de patología y/o tratamiento, incluyendo insuficiencia hepática y renal, y cáncer.
Omega Base es un complemento micronutricional a base de ácidos grasos omega 3 y omega 6. Aporta un alto y equilibrado contenido en ácidos grasos poliinsaturados omega 3 y omega 6, en una combinación y proporción que consiguen la mayor actividad biológica, impregnando la membrana plasmática y asegurando la formación de fosfolípidos y eicosanoides adecuados para el control de la inflamación crónica de bajo grado.
Amino Base es el conjunto equilibrado de aminoácidos esenciales y condicionalmente esenciales en forma libre, junto con nucleótidos, citidina, uridina y factores vitamínicos como colina y mioinositol. Los nucleótidos citidina y uridina, apoyan la función de la mucosa y el ecosistema intestinal.